晚期胰腺癌 III期MPACT 研究的总生存事后分析在ASCO 2014年会上进行了呈报
新泽西州萨米特 -- (美国商业资讯) -- Celgene Corporation (NASDAQ: CELG)今天发布了该公司III期MPACT(Metastatic Pancreatic Adenocarcinoma Clinical Trial,转移性胰腺腺癌临床试验)研究的总生存(OS)事后分析的更新结果,该研究探寻ABRAXANE®(紫杉醇蛋白质结合颗粒注射悬液)(白蛋白结合)联合吉西他滨用于转移性胰腺癌初治患者。该分析预定于美国中部时间6月1日星期天上午11:30在伊利诺伊州芝加哥召开的美国临床肿瘤学会(ASCO)第50届年会上进行壁报讨论。
该扩展数据截至2013年5月数据库最终锁定时,允许对来自于该研究中90%患者的成熟数据进行OS分析。该扩展分析显示,在意向治疗群体中,ABRAXANE联合吉西他滨延长OS优于单用吉西他滨[(中位OS为8.7 vs. 6.6个月)(HR0.72, P<0.0001),差值为2.1个月]。该分析显示,ABRAXANE联合吉西他滨组的生存期最长达3.5年(3.5年时,联合组存活患者为3%,吉西他滨单药组为0%)。1年和2年生存率与主要分析是一致的。
该分析还显示,对OS的治疗效应在该试验预设分析亚组中与各患者亚组是一致的。具体而言,Karnofsky体能状况(KPS) KPS 90-100的患者中,接受 ABRAXANE联合吉西他滨患者的中位OS比单用吉西他滨者长[中位OS 9.7个月 vs. 7.9个月(HR 0.77, P=0.0053)]。 KPS 70-80的患者也能维持一些收益[中位 OS 7.6个月vs. 4.3个月(HR 0.59, P<0.0001)]。
该项更新分析还评估了CA19-9和中性粒细胞-淋巴细胞比率(NLR)的预后效应。CA19-9升高者和NLR升高者,其生存时间均较短。此外,ABRAXANE联合吉西他滨治疗似乎能削弱CA19-9作为不良预后因子的效应,因为研究观察到,无论CA19-9水平如何,其总生存是接近的。
ABRAXANE联合吉西他滨对比吉西他滨单药治疗的MPACT研究中,最常见的≥3级治疗相关不良事件是中性粒细胞减少、周围神经病变和疲乏。ABRAXANE联合吉西他滨组17%的患者有3级周围神经病变(没有4级病例;54%有任意级别的周围神经病变)。ABRAXANE联合吉西他滨组接受平均疗程的患者中,7%出现3级神经病变。3级周围神经病变改善至≤1级的中位时间是29天,44%的患者重启ABRAXANE治疗。18%的患者出现≥ 3级疲乏。MPACT研究预设分析自2012年9月以来的主要结果发表于《新英格兰医学杂志》2013年10月31日刊。
ASCO壁报的详情:
- 摘要:#4027/壁报 #46:比较nab-紫杉醇(nab-P)联合吉西他滨(Gem)与Gem用于转移性胰腺癌(PC)患者(pts)的III期MPACT研究中总生存(OS)最新分析结果和中性粒细胞-淋巴细胞比率(NLR)及CA 19-9的预后效应。壁报:美国中部时间6月1日星期天上午8:00–11:00,地点:E 354b;壁报讨论:美国中部时间6月1日星期天上午11:30–中午12:45,地点:E厅D2。
- 这些结果来自于一项事后调查分析。
关于MPACT 研究
MPACT(Metastatic Pancreatic Adenocarcinoma Clinical Trial,转移性胰腺腺癌临床试验)研究由Celgene资助,为国际性随机开放研究,按1:1共随机分配共861例患者(431例分至ABRAXANE/吉西他滨组,430例分至吉西他滨组)。该研究的主要终点是总生存。次要终点是由独立放射学评审确定的无进展生存和总缓解率。其他终点包括由研究者确定的无进展生存和总缓解率,以及该患者群体中该联合用药的安全性和耐受性。
关于胰腺癌
胰腺癌是美国和欧洲第四大癌症相关死因。胰腺由两大类细胞构成:外分泌和内分泌。腺癌是外分泌肿瘤的一种亚型,约占各类胰腺癌症的95%。所有期别的胰腺癌汇总的5年生存率,美国约为6%,欧盟为5.7%。在美国,转移性胰腺癌的5年生存率约为1%。
关于ABRAXANE®
ABRAXANE是紫杉醇的白蛋白结合形式,采用nab® 专利技术生产。ABRAXANE的配方中含有白蛋白,白蛋白是一种人源性蛋白质,ABRAXANE的配方中不含溶剂。
2013年9月,美国食品药品管理局(FDA)核准ABRAXANE联合吉西他滨用于转移性胰腺腺癌患者的一线治疗。2013年12月,欧洲核准ABRAXANE联合吉西他滨用于转移性胰腺腺癌成人患者的一线治疗。
|
基于美国核准说明书的重要安全性信息 | ||
|
| ||
|
警示 – 中性粒细胞减缺乏 | ||
|
| ||
|
● |
|
基线中性粒细胞计数小于1,500 个细胞/mm3的患者不应给予ABRAXANE治疗。 为了监测骨髓抑制的发生(主要是中性粒细胞缺乏,中性粒细胞缺乏可能为重度、导致感染),建议所有接受ABRAXANE的患者经常检查外周血细胞计数 |
|
|
|
|
|
● |
|
注意: 相对于溶液中的药物,紫杉醇的白蛋白形式可能大幅影响药物的功能特性。请勿替代或换用其他紫杉醇剂型。 |
|
|
|
|
禁忌症
中性粒细胞计数
- ABRAXANE不得用于基线中性粒细胞计数< 1,500个细胞/mm3 的患者
超敏反应
- 对ABRAXANE 发生重度超敏反应的患者不得再次使用该药
警示与注意事项
血液学效应
- 骨髓抑制(主要是中性粒细胞缺乏)为剂量依赖性,是ABRAXANE的剂量限制性毒性。在临床研究中,转移性胰腺癌患者3-4级中性粒细胞缺乏的发生率为38%
- 通过经常检查全血细胞计数来监测骨髓毒性,胰腺癌在第1、8、15天给药之前
- 基线中性粒细胞绝对计数(ANC)小于1,500 个细胞/mm3的患者不应给予ABRAXANE
- 在胰腺癌患者中,当ANC低于500个细胞/mm3 或血小板低于50,000个细胞/mm3 时,停用ABRAXANE和吉西他滨,当下一周期第1天的ANC低于1500个细胞/mm3或血小板低于100,000 个细胞/mm3 时,延迟启动该周期。如果医生建议重新启用治疗,可适当降低剂量
神经系统
- 感觉神经病变为剂量依赖性、疗程依赖性
- 如果发生1级或2级感觉神经病变,一般无需调整剂量
- 如果发生≥3级感觉神经病变,必须暂停ABRAXANE治疗,必须恢复至≤ 1级,才能重启治疗,且所有后续ABRAXANE疗程均需降低剂量
脓毒血症
- 伴有或不伴有中性粒细胞缺乏的患者接受ABRAXANE与吉西他滨联合治疗后,5%会发生脓毒血症
- 胆道梗阻或存在胆管支架是重度或致死性脓毒血症的危险因素
- 若患者出现发热(无论ANC是否升高),应启用广谱抗生素治疗
- 对于发热性中性粒细胞缺乏,应停用ABRAXANE和吉西他滨,直至发热消退且ANC ≥1500个细胞/mm3,然后重启治疗,但剂量减低
肺组织炎症
- 患者接受ABRAXANE与吉西他滨联合治疗后,4%会发生肺组织炎症,部分病例可致死
- 在评估疑似肺组织炎症期间,应监测患者的体征和症状,并停用ABRAXANE和吉西他滨
- 肺组织炎症一旦确诊,应永久性停用ABRAXANE 和吉西他滨治疗
超敏反应
- 重度及偶而致死性超敏反应(包括过敏反应)已有报道
- 对ABRAXANE 发生重度超敏反应的患者不得再次使用该药
肝脏损害
- 由于肝脏损害时紫杉醇暴露及毒性可能增加,肝损患者须慎用ABRAXANE
- 中度或重度肝损的胰腺腺癌患者,不建议使用ABRAXANE
白蛋白(人源性)
- ABRAXANE含有源自人类血液的白蛋白(人源性)
孕期用药: 妊娠D类
- 孕妇给予ABRAXANE能引起胎儿损害
- 孕期用药或用药期间妊娠,患者必须知晓该药对胎儿的潜在危害
- 必须告知有可能妊娠的女性避免在ABRAXANE用药期间妊娠
男性用药
- 必须告知男性在ABRAXANE用药期间不应使女方受孕
不良反应
- III期研究中最常见(≥20%)的不良反应中,ABRAXANE/吉西他滨组发生率比吉西他滨组高≥5%的有中性粒细胞缺乏(73%, 58%)、疲乏(59%, 46%)、周围神经病变(54%, 13%)、恶心(54%, 48%)、脱发(50%, 5%)、外周水肿(46%, 30%)、腹泻(44%, 24%)、发热(41%, 28%)、呕吐(36%, 28%)、食欲减退(36%, 26%)、皮疹(30%, 11%)和脱水(21%, 11%)
- 最常见不良反应中,ABRAXANE/吉西他滨组3-4级毒性发生率比吉西他滨组高≥2%的有中性粒细胞缺乏(38%, 27%)、疲乏(18%, 9%)、周围神经病变(17%, 1%)、恶心(6%, 3%)、腹泻(6%, 1%)、发热(3%, 1%)、呕吐(6%, 4%)、食欲减退(5%, 2%)和脱水(7%, 2%)
- 血小板缺乏(所有级别)的报告率,ABRAXANE/吉西他滨组为74%,吉西他滨组为70%
- ABRAXANE最常见(发生率高≥1%)的严重不良反应是发热(6%)、脱水(5%)、肺炎(4%)和呕吐(4%)
- 导致ABRAXANE永久性停药的最常见不良反应是周围神经病变(8%)、疲乏(4%)和血小板缺乏(2%)
- 导致ABRAXANE剂量降低的最常见不良反应是中性粒细胞缺乏(10%)和周围神经病变(6%)
- 导致ABRAXANE暂停或延迟给药的最常见不良反应是中性粒细胞缺乏(16%)、血小板缺乏(12%)、疲乏(8%)、周围神经病变(15%)、贫血(5%)和腹泻(5%)
- ABRAXANE/吉西他滨组所有级别毒性发生率比吉西他滨组高≥5%的其他入选不良反应有无力(19%, 13%)、粘膜炎(10%, 4%)、味觉障碍(16%, 8%)、头痛(14%, 9%)、低血钾(12%, 7%)、咳嗽(17%, 7%)、鼻出血(15%, 3%)、尿路感染(11%, 5%)、肢端疼痛(11%, 6%)、关节痛(11%, 3%)、肌痛(10%, 4%)和抑郁(12%, 6%)
- ABRAXANE/吉西他滨组3-4级毒性发生率比吉西他滨组高≥2%的其他入选不良反应有血小板缺乏(13%, 9%)、无力(7%, 4%)和低血钾(4%, 1%)
ABRAXANE及其他紫杉醇剂型的上市后经验
- ABRAXANE用药中,重度及偶而致死性超敏反应已有报道。既往对紫杉醇注射或对人源性白蛋白发生超敏反应的患者中,ABRAXANE的用药尚未进行过研究
- ABRAXANE用药中,充血性心力衰竭、左室功能障碍和房室传导阻滞已有报道,主要见于伴有基础心脏病史或既往暴露于心脏毒性药物的个体
- ABRAXANE用药中,药物渗出血管外已有报道。鉴于药物渗出血管外的可能性,建议在给药期间密切监测ABRAXANE输注部位,以防可能的浸润
药物相互作用
- ABRAXANE与已知能抑制或诱导CYP2C8或CYP3A4 的药物合并用药时必须加以注意
特殊人群用药
哺乳母亲
- 紫杉醇是否在人类乳汁中分泌尚属未知。由于众多药物在人类乳汁中分泌、有可能引起母乳喂养的婴儿发生严重不良反应,必须在中止母乳喂养与停药之间作出抉择,同时考量药物对母亲的重要性
儿科
- ABRAXANE在儿科患者中的安全性和有效性尚未进行过评估
老年
- 接受ABRAXANE和吉西他滨的胰腺腺癌患者中,65岁或以上者的腹泻、食欲减退、脱水和鼻出血比65岁以下者多见
肾功能损害
- ABRAXANE的使用尚未在肾功能损害患者中进行过研究
剂量和给药
- 胆红素≥ 正常值上限的1.26倍或AST >正常值上限的10倍时,暂停ABRAXANE
- 若有重度血液学、神经系统、皮肤或胃肠道毒性,可能需要减量或停药
- 密切监测患者
请参阅完整处方信息,包括黑框警示语,请访问: http://abraxane.com/downloads/Abraxane_PrescribingInformation.pdf
关于 Celgene
Celgene Corporation总部位于美国新泽西州萨米特,是一家综合性全球制药公司,主要从事通过基因和蛋白调节治疗癌症和炎症性疾病的创新型疗法的发现、开发及商品化业务。进一步信息,请访问www.celgene.com。请在Twitter上关注我们 @Celgene
前瞻性陈述
本新闻稿包括前瞻性陈述,前瞻性陈述为并非历史事实的一般性陈述。前瞻性陈述可通过“期望”、“预计”、“认为”、“打算”、“估计”、“计划”、“将要”、“前景”等词语及类似表述加以辨别。前瞻性陈述基于管理层当前的计划、估计、假设和预测,并仅就它们制定之时而言。除非法律要求,Celgene Corporation不承担根据新信息或未来事件对任何前瞻性陈述进行更新的责任。前瞻性陈述涉及固有的风险与不确定性,这些风险与不确定性多数难以预测且通常超出我们控制。在多种因素的影响下,实际结果或成果可能与前瞻性陈述中表明的那些结果或成果存在实质性差异,其中许多实际结果或成果在Celgene Corporation向美国证券交易委员会提交的10-K年报及其他文件中均有详细论述。
免责声明:本公告之原文版本乃官方授权版本。译文仅供方便了解之用,烦请参照原文,原文版本乃唯一具法律效力之版本。
联系方式:
代表 Celgene:
投资者:
908-673-9628
investors@celgene.com
或
媒体:
908-673-2275
media@celgene.com
本文链接:http://www.iruis.com/News/cninfo/34334.shtml
热门资讯
BAT,视频圈的天下现在“也”是你们的了!
点击:550
乐居四个身份之间的商业逻辑
点击:107
科技IPO市场还有生命力吗?
点击:102
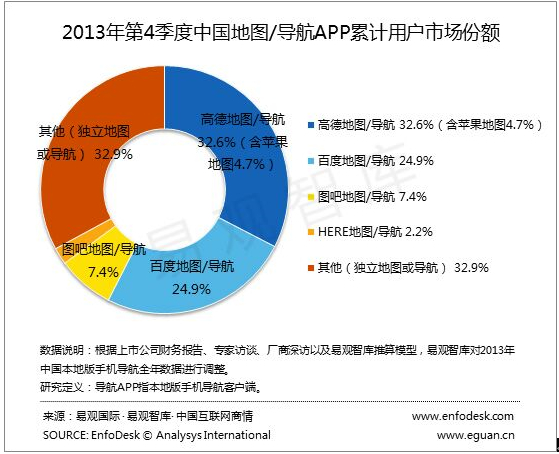
易观2013Q4手机地图报告出炉 高德百度图吧位列前三
点击:75
研究:三大特性看明白中国电影市场
点击:65
图吧合伙人:一分钟收入千元不是梦 是噱头还是炒作…
点击:64
图吧导航新版出炉 五一出行游玩更安全
点击:56
图吧合伙人等于发财梦?荒唐!
点击:56
为什么风投纷纷涌入内容营销领域?
点击:49
图吧回应注册合伙人即送1000元传闻
点击:44